考えたことをそのまま書いてみました
日曜から進めている理論化学は、電子の収容順位のところを学習しています。有機化学でも何度か出てきましたが、改めて自分で周期表からいくつかランダムでピックアップして書いてみて、電子の入り方を確認しました。
そこからいろいろと「?」が湧き上がってきたので、昨日は調べつつその都度ワードに記録を残しつつ進めてみました。
まず、遷移元素の中にいくつか挙動不審な元素(Cr、Cuなど)を発見。
例えばCr。ひとつ前のバナジウムの電子配置はこちらです。次のクロムは、赤い矢印のところに普通なら収まりますよね。
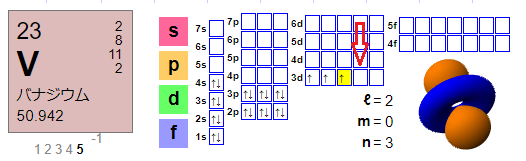
ところが実際はこちらです。
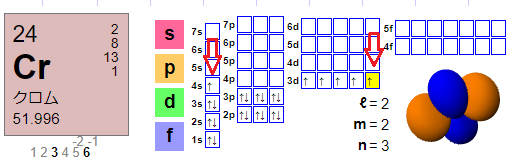
順番からしたら3d軌道の4番目の部屋に入ると思いきや、なんと4s軌道の下向きスピンを一つ奪って3d軌道の小部屋を埋めてしまいました。
いやいや、エネルギー準位からして4s軌道を埋めてから3d軌道じゃないの?えらいフリーダムだな、と思いながらも同じような現象が他のいくつかの遷移元素でも起きているのを上の図でも引用した便利な周期表で確認しました。
なぜこうなるのだろう?と考えました。
エネルギーの低い軌道から順番に入るっているルールを破ってはいるものの、s軌道に入っていた電子がその内側の殻のd軌道に移動してd軌道を不対電子で満たすような動きだったので、たぶんこのほうが安定するんだろうなと考えました。
とにかく人も電子も安定第一。有機化学でカルボカチオンの中間体の安定化とか、ベンゼン環の共鳴安定化とか、いろいろやったので安定志向だけは身につきました。でも肝心のなぜ安定するのか?はわからず。
ここから、調べものに入ります。
どうやら電子の入り方には「同じ部屋には2個まで」ルールと、「エネルギーの低い順に」ルールだけでなく、「第三のルール」が存在しているのだとわかりました。
それは「スピンを違う部屋に同じ向きに入れると安定する」という、フントの規則と呼ばれているルールです。ペアになっていない電子が多いほど安定化するようで、d軌道でいえば、d軌道の5つの小部屋がすべて上向きのスピンのみで構成されていると、かなり安定化するということです。(d軌道が全て上下の電子対で満たされた方がそれよりも安定します)
このあたりはがっつり物理が絡んで来て、例外もあるようなのでかなり表面的な理解にとどまっています。とりあえず安定化の方向に向けて電子が埋まっていくんだな、というところで終わりにしました。
・・・と言いたいところですが、次から次へいろんな疑問が湧き上がってきたので今日まで、と期限を区切ってもう少し調べることにしました。
ひとつは磁性についてです。
いろんな資料を見るうちに、スピンの動きが磁性と深く関わりがあり、スピンが上下入っている(電子対になっている)と磁性は打ち消され、不対電子が多く残っているほど磁性が強いことがわかりました。
じゃあ例えばマンガンは3d軌道にペアになってない不対電子が5つ、鉄は1つがペアになっていて、不対電子が4つ。だからマンガンのほうが磁性が強いといえるのか?
・・・と思って調べたのですが、そもそも磁性とは何かが良くわかっていないことに気付きました。そしてなにやら超磁性やら強磁性やら出てきたのでこれも中途半端ですがここまでに。
もうひとつは、銅の価数と電子の入り方についてです。
電子の入り方のルールを自分なりに理解して、 銅とクロムの電子の入り方をノートにまとめていた時に思ったことがあります。
銅の電子の入り方です。

4s軌道のほうがエネルギーが低いので4s軌道が先に埋まり、3d軌道は4つの電子対と1つの不対電子になる・・・のではなく、3d軌道を埋めたほうが安定するので、4s軌道を埋めずにまず3d軌道を埋めるのだと理解しました。
この埋め方だと最外殻は4sで価電子数は1、ということはイオンの価数は1。もしエネルギーの低い方から、のルールだけで入った場合4s軌道を埋めるので価数は2。銅イオンはCu⁺とCu2⁺があった。これって関係しているのかな?
・・・と思い調べようと思いましたがここで時間切れで調べていません。
いろいろ誤解しているところもありそうですが、たぶん、またこのあたりはまたどこかで出てくるような気がしますのでとりあえずここまでにします。
<参考にしたサイト>
http://hyper-chemistry.blog.so-net.ne.jp/2011-03-02
https://ja.wikipedia.org/wiki/%E3%83%95%E3%83%B3%E3%83%88%E3%81%AE%E8%A6%8F%E5%89%87
http://park.itc.u-tokyo.ac.jp/kojimalab/lecture/kisogen02.pdf
https://www.molecularscience.jp/lecture/BasicInorg_06.pdf
http://www.chem.utsunomiya-u.ac.jp/lab/mukizai/jiseitai.pdf
4/1(日)・ 4/2(月)の学習記録
4/1(日)学習時間:10h40m
項目: 昨日の復習+マクマリー有機化学の該当部分を読む
目標: 1h 実績: 1h
項目: 岡野の化学(80)理論化学①スタート
目標: 2h30m 実績: 5h30m
メモ: 元素と原子から。有機化学の時にもやったが、いざ自分で原子の構造を書こうと思うと書けないことに気付く。同位体、遷移元素・典型元素、アルカリ金属元素、電子軌道などについても復習。
項目: 岡野の化学(81)
目標: 2h30m 実績: 2h
項目: 岡野の化学(82)
目標: 3h 実績: 1h40m
項目: 岡野の化学(83)
目標: 2h 実績: 30m(残り50%)
項目: 印刷しっぱなしの明細書を読む。整理する。
目標: 2h 実績: 1h50m
メモ: 明細書はほとんど読まず。明細書の整理と隙間時間で視聴したビデオセミナーがここ数週間聞きっぱなしになっていたので気になったものを少し聞きなおして、メモ。(ビデオセミナーの内容は、勉強法、明細書の読み方、考える練習など)
4/2(月)学習時間:6h40m
項目: 昨日の復習
目標: 30m 実績: 30m
項目: 岡野の化学(83)残り50%
目標: 1h 実績: 3h30m(電子の入り方についての調査時間含む)
項目: 岡野の化学(84)
目標: 2h30m 実績: 2h40m
メモ: 同位体、同素体、単体・化合物。ある概念が出てきたら、対抗概念は何かと考える。似たようなABCの概念があれば、 それぞれの違い、関係性を調べる。わからない概念をなんとなくでうやむやにして、それぞれの境界線がぼやけている言葉がいくつもあるので、今後意識していきたい。
項目: 岡野の化学(85)
目標: 1h 実績: 未完了
4/3(火)の行動予定
項目: 昨日の復習
目標: 30m
項目: 岡野の化学(85)
目標: 2h
項目: 岡野の化学(86)
目標: 2h
項目: 岡野の化学(87)原子の構造・演習問題
目標: 2h