答え合わせをして気づくこと
昨日はまずイオン化エネルギーについてのビデオセミナーを進めました。
その前日にスピンを書いたりなんだりして自分なりに主な原子について、相対的になぜそのイオン化エネルギーの大きさになるのかの理由を考えてからの視聴だったので、自分の思考がずれていたポイントや、全く考えていなかったことがわかりました。
- 電子の遮蔽効果について考えていなかった
- 1個目の電子を取り去るエネルギーであれば、第一イオン化エネルギー。言葉は正しく使う。
- なぜ、気体状態の原子であり液体でも固体でもないのか、考えていなかった。というより、「気体状態」に全く目が留まっていなかった
このあたりの気づきも、自分で先にやったからこそかなと思います。
ということで、イオン化エネルギーに続いて電子親和力です。(明日のタイトルが透けてみえるような)
同じように、主な原子の電子親和力のグラフをもとにして、一旦ビデオを止めてそれぞれの原子の電子親和力についてなぜその位置にいるのかを考えてみました。
またもやスピンを書きました。そろそろ、1s²2s¹とかの表記に慣れたほうが良いのでしょうが、スピンの入っている状態が一目でわかる方が断然考えやすいです。
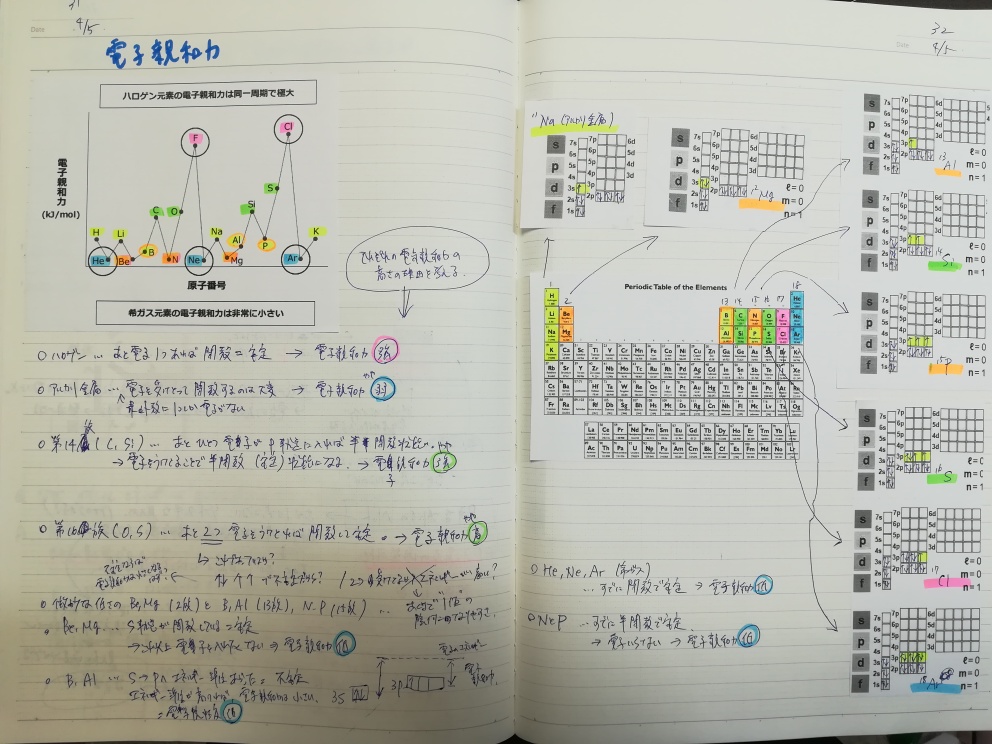
考え方は、イオン化エネルギーと同じですね。つまり、電子を受け取って安定になるのか、今の状態ですでに安定だから余計な電子はいらないのか。最外殻電子の電子配置によって電子親和力が変わります。
すでに安定状態=これ以上電子はいらない=電子親和力の低いグループ
- すでに閉殻していて安定状態の希ガス
- 半閉殻状態の15族(N、P)
- s軌道に電子が2つ入っていて安定状態の第2族(Be、Mg)
あと少し電子があれば安定になる=電子欲しい=電子親和力の高いグループ
- 電子1つ受け取れば安定な希ガスと同じ電子配置になるハロゲン
- 電子1つ受け取ればそこそこ安定な半閉殻状態となる第14族(C、Si)
- 電子2つ受け取れば安定な希ガスと同じ電子配置になる第16族(O、S)
*16族については、もやもやとしている部分があります。あと2つ電子を受け取らなくてはならないわけですが、電子親和力は1価の陰イオンになる時に放出するエネルギーですよね。その段階では、p軌道には1組の上下スピンと2つの上向きスピンの計4つの電子が入っている状態で、この状態は不安定であるので軌道のエネルギーが高くなり、結果として電子親和力は低くなるのでは・・・とも思いました。ちょっと保留にしておきます。
電子を1つもらったところで安定しない=電子親和力がそこそこ低いグループ
- 最外殻電子数が1のアルカリ金属
- s軌道からp軌道へ軌道が変わり、軌道のエネルギーが高くなった(=電子親和力が低くなった)第13族(B、Al)
さて、ビデオを進めてずれてないか確認していきます。
4/5(木)の学習記録
学習時間:6h15m
項目: 昨日の復習+資料をノートにまとめる
目標: 45m 実績: 1h25m
メモ: ノートに資料をまとめる過程で遮蔽効果についてよくわかっていないことに気付く。調べつつノート作成。
項目: 岡野の化学(89)
目標: 2h 実績: 2h
項目: 岡野の化学(90)
目標: 2h30m 実績: 20%(2h50m)
メモ: 主な原子の電子親和力について調べる
項目: 岡野の化学(91)
目標: 2h30m 実績: 未完了
4/6(金)の行動予定
項目: 昨日の復習
目標: 15m
項目: 岡野の化学(90)残り80%
目標: 2h
項目: 岡野の化学(91)
目標: 2h30m
項目: 岡野の化学(92)演習問題 or 学んだ内容に関連する特許明細書を読む
目標: 2h30m








