3点セットの続き
イオン化エネルギー、電子親和力と来たら、次は電気陰性度です。
昨日はまず、前日自分で調べていた電子親和力についてのビデオ視聴を進めました。
講座では電子親和力の値を確認していて、そういえばグラフと周期表で傾向はつかんでいたものの、具体的な電子親和力を数値として確認していなかったことに気付きました。
ということで、再度グラフ、周期表の色分けと電子親和力の数値を対比させました。

まず、あれですね。全部欲張って取り上げるとポイントがぼやけますね。
重要なところ(上と下と中間の3つとか)でとどめておいた方が断然わかりやすくなったかなと思います。
それでも、それぞれに対応させて具体的な数値で見て改めて見えてきたこともありました。
基本的には周期が下に行くほど電子親和力も下がるはずですが、第2周期と第3周期を比較すると第3周期のほうが高くなっている、とかですね。これは原子の大きさが第2周期は小さいため、電子同士の反発が強まり不安定になるから、という理由ですね。
電気陰性度についても、定義の確認と周期表上に電気陰性度を記した表が出てきたあたりでビデオを一旦ストップし、表から何が読み取れるか、自分で考えてみる課題を設定し、ノートへ書きました。
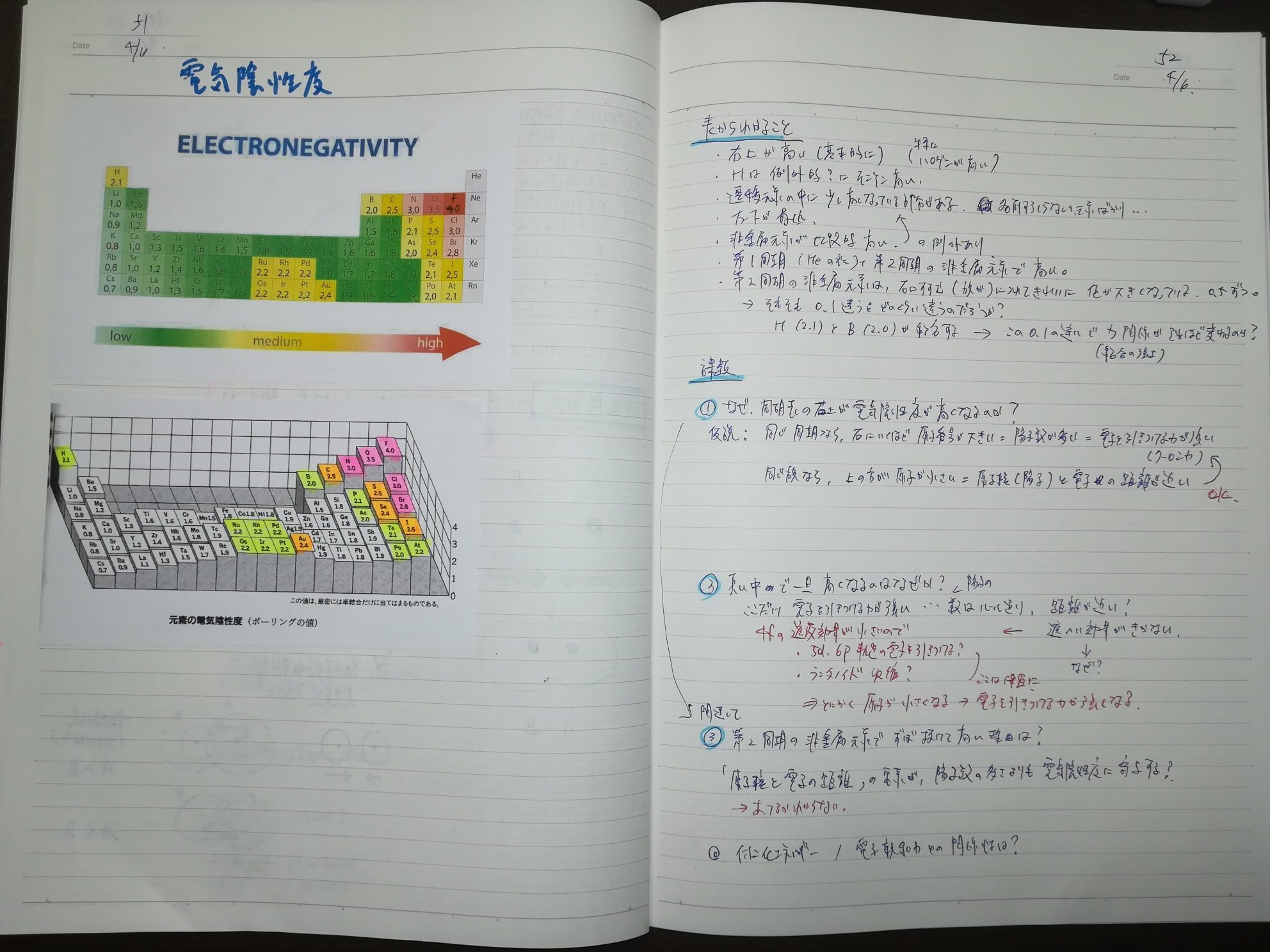
課題と自分で考えた結論(仮説)は、下記3点です。
1.なぜ周期表の右上が電気陰性度が高いのか。
(仮説)同じ周期ならば右側に行くほど陽子数が多い、つまり電子を引き付ける力が強い。そして同じ族ならば下に行くほど原子が大きくなるため、原子核と電子の距離が遠くなり、電子を引き付ける力が小さくなる。したがって、周期表の右上で高くなる
2.真ん中あたりで一旦高くなるのはなぜか。
(仮説)陽子の数については変えられないと思うので、何らかの理由で原子核と電子の距離が近くなっていることで、電気陰性度が上がったとみるべき。ではなぜ距離が近くなったのか?について明確な答えは出せず。遮蔽効果が関係しているのかも。
3.(1と関連して)第二周期の非金属元素でずば抜けて高いのはなぜか。
(仮説)陽子数の違いより、原子の大きさ(最外殻電子と陽子との距離)の違いのほうが、電気陰性度の違いに寄与しているから。
じっくり調べられていませんが、1.3.に関してはこの通り(3.は根拠に乏しい感じですが)かと思います。
2.については、ランタノイド収縮?で原子半径が縮まる?とか4f軌道の遮蔽効果が小さいため、とかなんとなくこれかな?という理由が出てきましたが、内容が理解できていません。ここの謎に高くなっている部分の原子半径と電子陰性度はどうなっているのかなと思い調べてみましたが、数値がまちまちだったり(イオン半径とか違う概念?の表も混じっていた?)、他にもっと原子半径は小さいのに電子陰性度は低いところがあったりなどで、?だらけで終わっています。
ということで、今日も引き続きじっくりと進めていきます。
4/6(金)の学習記録
学習時間:6h
項目: 昨日の復習
目標: 15m 実績: 10m
項目: 岡野の化学(90)残り80%
目標: 2h 実績: 2h55m
項目: 岡野の化学(91)
目標: 2h30m 実績: 2h55m(50%完了)
メモ: 電気陰性度に入る。似たような3つの概念があった時、同じ部分、違う部分は何かを考える。図解化する。図解化に関する本を読みっぱなしになっていて実行できていないので、ノートをまとめるときに図解化できないか意識してやっていく。
項目: 岡野の化学(92)演習問題 or 関連する特許明細書を読む
目標: 2h30m 実績: 未完了
メモ: 明細書から離れているので読みたいと思って計画にいれたもののそんな時間はどう考えてもなかった。週末に持ち越し。
4/7(土)の行動計画
土曜は目いっぱい勉強します。14時間半を目標に。
項目: 岡野の化学(91)残り50%
目標: 1h30m
項目: 岡野の化学(92)演習問題
目標: 1h30m
項目: ここまでの復習。明細書でどのように使われているのか調べて、キーワード部分だけ拾って読んでみる。
目標: 2h
項目: 岡野の化学(93)化学結合
目標: 3h
項目: 岡野の化学(94)ここまでの復習
目標: 2h30m
項目: 岡野の化学(95)共有結合
目標: 3h