Contents
ここまでのまとめ
この記事は、酸の強さについて考えてみた その1(仮説編)の続きとなります。
ここでは、酸の強さについて自分で調査して得たかっこつきの「解答」をご紹介します。
●課題
強酸と弱酸の違いは何か。電離度を決定する要素は何か。
●仮説
電気陰性度の違いや電子殻の違い、水素結合が影響している?(決定的な要素は考えつかず)
●解答
酸の電離度を決定する要素は、共役塩基の安定性である。
仮説と解答との差、気付いたこと、今後の課題はまた次の記事にまとめます。
そもそも酸性が強いとは?
水溶液中に水素イオン(H⁺)が多く電離していると、酸性が強くなります。
多く電離するには、電離した方が物質として安定するから、と考えます。不安定であれば電離せずに元の状態にとどまる分子が多く、電離度が低い、つまり酸性度も低いということになります。
水素イオンが電離すると同時に、水素イオンと結合していた物質も電離します。この物質が、共役塩基と呼ばれる物質です。
共役塩基が水溶液中で安定であれば、相手方の水素イオンも多く電離するということになります。
具体的な例で説明します。
・・・とその前に、酸と塩基にはいくつか異なった定義があります。ここでは、ブレンステッド・ローリーの定義に基づいて話を進めます。
ブレンステッドは、酸と塩基を次のように定義しています。
酸:プロトン(H⁺)を供与するもの
塩基:プロトンを受け取るもの
そして、酸からプロトンを供与された結果生じた物質が共役塩基、
塩基がプロトンを受け取った結果生じた物質が共役酸と呼ばれます。
例を挙げます。
塩化水素が水中で塩化物イオンとオキソニウムイオンに電離
HCl (酸) + H₂O (塩基)→ Cl⁻(共役塩基)+ H₃O⁺ (共役酸)
酢酸が水中で酢酸イオンとオキソニウムイオンに電離
CH₃COOH (酸)+ H₂O (塩基)⇔ CH₃COO⁻(共役塩基)+H₃O⁺ (共役酸)
塩酸は強酸で、酢酸は弱酸とされています。
下記の図のように、塩化水素はほとんど電離してしまうのに対し、酢酸は電離している分子が塩酸と比較すると少ないためです。

(こちらよりお借りしました)
塩化物イオン(Cl⁻)はイオンの状態で安定する=より多く電離する=酸性度が高くなる
酢酸イオン(CH₃COO⁻)はイオンの状態だと不安定=あまり電離しない(電離しても、不安定なのでもとの酢酸に戻りやすい)=酸性度が低くなる
共役塩基を中心にして考えると、よりわかりやすくなりますね。
共役塩基の安定化とは?
ここまでで、共役塩基が安定化すると酸が強くなることがわかりました。
では、共役塩基はどのような条件で安定化するのでしょうか。
ここでは、下記の3つの要素を上げてみたいと思います。
(1)共役塩基の原子の電気陰性度が大きい
(2)共役塩基の原子が大きい
(3)共役塩基の電子が非局在化している
(1)からみていきましょう。
(1)共役塩基の原子の電気陰性度が大きい
電気陰性度については、仮説編でちょっとお話をしました。原子が電子を引っぱる強さのことですね。

(WIKIBOOKSよりお借りしました)
原子核と最外殻電子の距離が近く、また電荷が大きいほどこの力は強くなります。
ですので、周期表の右上ほど強くなります。
電気陰性度が大きな原子はその負電荷を保持した状態でも安定するのです。
上の表の通り、電気陰性度はF>O>N>Cになります。
酸の強さもフッ化水素(HF)>水(H₂O)>アンモニア(NH₃)>メタン(CH₄)となります。
酸の強さについては、ここまで強酸、弱酸とか酸性度が高いとか抽象的なお話をしてきましたが、実は酸解離定数(pKa)という酸の強さを数値化したものがあります。酸解離定数が小さいほど、酸性度が高くなります。
こちらの表がまとまっていてわかりやすかったです。(こちらよりお借りしました)
先ほどの酸の強さにpKaを足すと、フッ化水素(HF) pKa3.2 >水(H₂O) pKa15.7>アンモニア(NH₃)pKa36 >メタン(CH₄)pKa49 となります。
なるほど。電気陰性度が大きいほど安定して、酸性度も高くなる。と納得したいところですが、仮説編でわからなかった、「フッ化水素はなぜ他のハロゲン化水素と比較したら弱酸なのか」の説明がつきません。
ハロゲン化水素のpKaは、次の通りです。pKaが小さいほど強酸なので、フッ化水素が他の酸より弱酸であることがわかります。
- フッ化水素酸(HF) pKa3.2
- 塩酸(HCl) pKa -7
- 臭化水素酸(HBr) pKa -9
- ヨウ化水素酸 (HI) pKa -10
この問題を解決するには、次の(2)の要素を見ていく必要があります。
(2)共役塩基の原子が大きい
原子が大きいほど最外殻電子は原子から遠くなり、遠いほど電子が存在する空間(軌道)も広くなります。
電子は局地的に集まっているより、分子全体に広く分散していた方が安定します。
この、「電子が分子全体に広く分散していた方が安定」という概念が共役塩基の安定化を考える上で重要になります。
さて、問題のフッ化水素ですが、フッ素が第2周期に属するため下の周期に属する塩素、臭素などと比較すると原子はとても小さいです。
原子の大きさが異なる場合は、その大きさの違い、つまり電子が広範囲に分散しているかどうかの方が、電気陰性度の違いよりも共役塩基の安定化に与える影響は大きい、ということになります。
なので、電気陰性度の高いフッ素からなるフッ化水素は他のハロゲン化水素より酸性度が低かったのですね。
(3)共役塩基の電子が非局在化している
(2)で「電子が分子全体に広く分散していた方が安定」というお話をしました。
ここでお話する「非局在化」も同じことで、電子の偏り(電子密度の偏り)をなくす、つまり非局在化するほど、共役塩基は安定化します。
ではどうしたら電子の非局在化が起こるのでしょうか。
ここでは、誘起効果と共鳴効果という2つの効果についてご紹介します。
1.電子求引性基による誘起効果
酢酸(CH₃COOH)の共役塩基である酢酸イオン(CH₃COO⁻)で考えます。
H⁺を失っているので、カルボキシ基(COO⁻)部分に電子が集中し、分子全体の電子密度の偏りが生じます。偏りが生じた状態は不安定です。
メチル基部分の水素がハロゲン原子などの電気陰性度の大きな置換基で置換されると、置換基は局在化していた電子を自らの方へ引き寄せ、イオン全体の電子の偏りをなくします。
結果、安定するので酸性度は高くなります。このような置換基は電子求引性基と呼ばれます。
ノートの一部を貼り付けます。電子求引性基であるClやFが多く置換されるほど、酸性度が強くなっていますね。
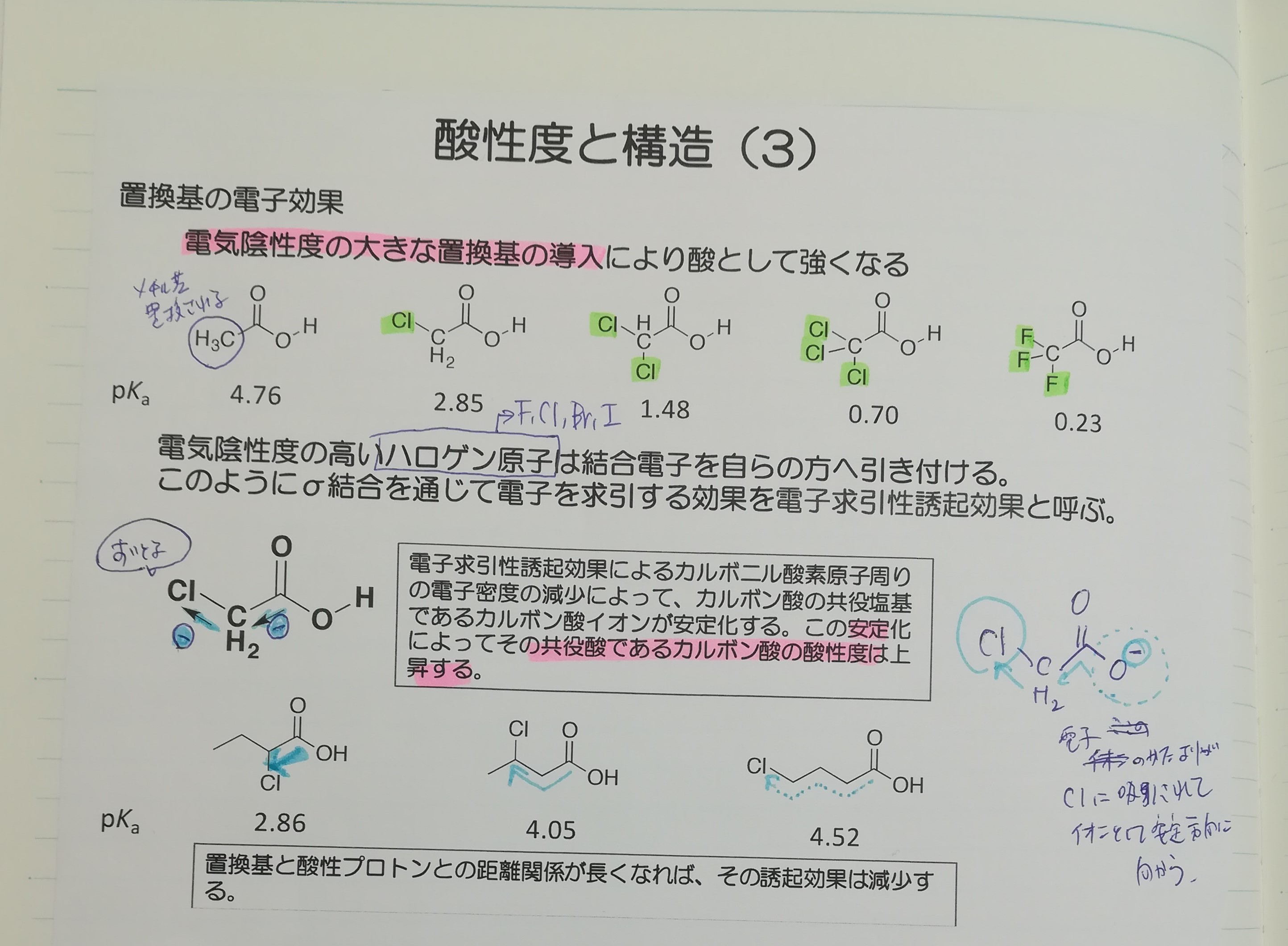
また、電子求引性基と逆の作用を及ぼす電子供与性基が結合している場合、局在化しているところにさらに電子を送り込むため、ますます不安定となり、酸性度は低くなります。
電子供与性基の代表例は、おなじみのメチル基(CH₃⁻)です。
ですので、同じカルボキシ基を持つギ酸(HCOOH)、酢酸(CH3COOH)の酸性度を比較すると、電子供与性基であるメチル基を持つ酢酸のほうが、安定度が下がり酸性度は低くなります。
(ギ酸:pKa 3.77 酢酸:pKa4.76)
2.共鳴効果
もう一つは、共鳴による安定化です。
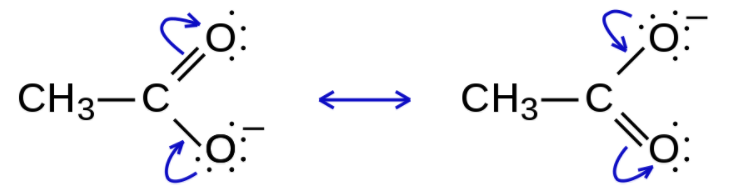
共鳴。聞き慣れない言葉ですね。まずはこちらの酢酸イオンの構造式をご覧ください。
(こちらよりお借りしました)
図の通り、どちらの構造式も成立します。
このように、電子の移動だけで原子核の移動がない構造を、共鳴構造と言います。原子の位置を変えずに複数の構造式を書けるということは、それだけ電子が自由に動き回っている、つまり電子が分子全体に分散していることになります。
そのため、安定化します。
電子は高速で動いており、正しい状態を表す構造式が書けないので2つ以上の可能性のある構造式(共鳴構造式)を書いています。
さて、この酢酸についてはここまで何度か取り上げてきました。
一般に弱酸に分類され、メチル基の電子供与性によって不安定化し、メチル基を持っていないギ酸と比較したら酸性度は弱まると説明しました。
でも、その反面共鳴効果は酢酸イオンの安定化をもたらしますよね。
またアルコール(中性、pKa16) と比較したら酸性が強いということもできます。
pKaがいくつより下が強酸、という決まりもありません。
強酸・弱酸という概念はあくまで相対的なものなので、何と比較するか、何のために比較するかが重要だと感じました。
ここまで、自分で調べた内容をまとめました。
最後に仮説と回答の差、そして今後の課題についてまとめます。
その3へ続きます。
参考にさせていただいたサイト





フッ化水素酸が何故弱酸であるかについてですが、参考書などの書籍では水素結合による影響と書かれていることが多いです。
N原子よりもCl原子の方が電気陰性度が大きいにも関わらずCl原子が水素結合を伴わないかについては、
Cl結合が原子半径が大きいために表面の電荷密度が小さく、N原子よりも水素イオンを引き付けにくいからです。
ちなみに、電子が分子全体に広く分散していたほうが安定、というのは原子半径が大きい方が内部での電子同士の反発力が小さいからです。
文中で酸性度の低さについて言及されていますが、F原子は水素結合を伴うため、と言う内容も記載されたほうが良い気がします。
ななな様
はじめまして。asaと申します。
コメントありがとうございます。
フッ化水素が弱酸である理由に
「F原子は水素結合を伴うため」という内容を記載した方がよいのでは、
という点について、お答えします。
この記事は化学の勉強の過程で学んだことをまとめる目的で作成しました。
その際に、さまざまな文献を参照しました。
確かに「HF間の水素結合によってフッ化水素の状態で安定であるから」
という理由が記載された資料もありましたが、
当時、手持ちの信頼できる文献でそのような記述が見当たらず、記事に記載しませんでした。
確かにHF結合は結合エネルギーが高いため電離しにくいと思われますが、
それが酸の強さにどれほど影響しているかについて明記された文献は見当たりません。
フッ化水素が他のハロゲン化水素よりも弱酸性となるのは、
やはりフッ素原子の原子半径の大きさが他と比べて圧倒的に小さく、
ななな様も指摘されているように、
原子半径が大きいほうが反発力が小さい(電子の非局在化による安定)という要素が大きい、
と考えるのが自分自身一番納得のいく説明でした。
記事の最後にもありますが、このあたりの資料を参考にしています。
九州大学の資料
「原子の大きさがことなる場合は、電気陰性度の違いよりも、
その大きさが酸性度へ強く影響する。」との記載があります。
http://www.scc.kyushu-u.ac.jp/Yuhan/Top_Page/uchida_lab/_src/510/%E6%9C%89%E6%A9%9F%E7%89%A9%E8%B3%AA%E5%8C%96%E5%AD%A6%EF%BC%88%E9%85%B8%E3%81%A8%E6%A7%8B%E9%80%A0%EF%BC%89.pdf
高校教師の方のサイトより
酸と塩基(酸と塩基の強さ)
(iii)ルイスの定義→(2)酸と塩基の強さに詳細が記載されています。
http://sekatsu-kagaku.sub.jp/acid-base.htm
なるべく裏取りをして間違いの無い記事を書くようにしていますが、
一学習者であり専門家でないため誤りやわかりにくい表現があるかと思います。
また何かお気づきの点がございましたらコメント頂けますと幸いです。