B、O、Al、Sのイオン化エネルギーはなぜ低いのか?
昨日は1日中イオン化エネルギーのことを考えていました。夜になったら電子が飛び出す時ってどんな気持ちなんだろう、とかまで考えるほどすっかり入り込んでました。
朝はまず、イオン化エネルギーの表の各元素を色分けして電子の入り方を確認しました。
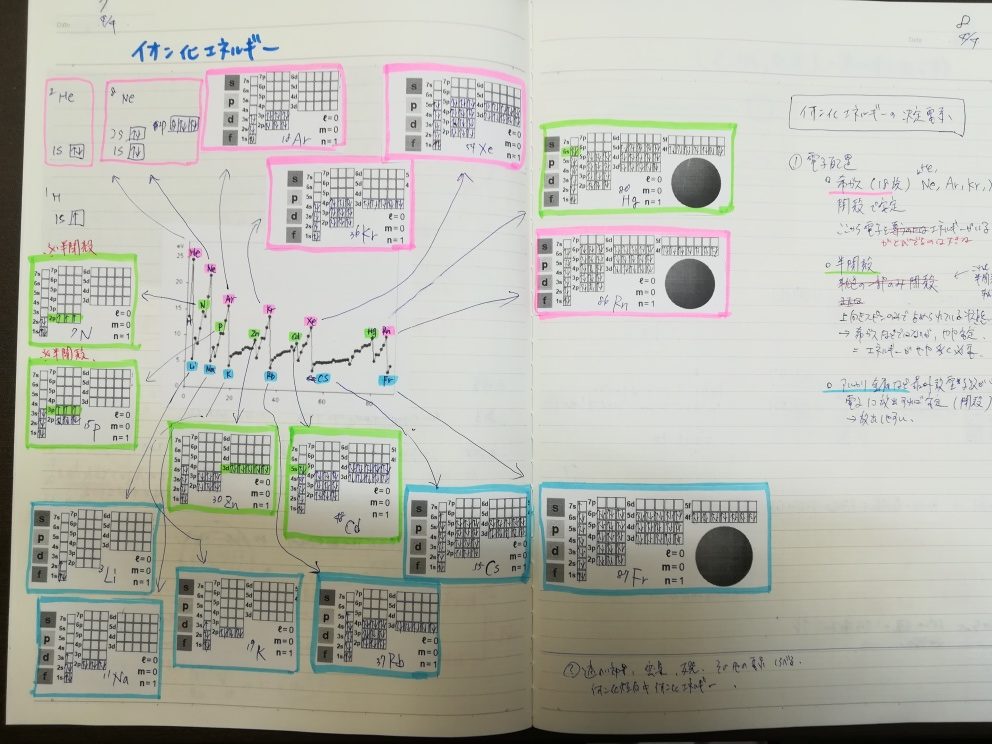
7s軌道までスピンを書いたのは初めてです。これだけ書くと、さすがに体になじんだ感じがします。
ピンクの部分は第18族元素(希ガス)で、この状態で安定化しているのでここから1価の陽イオンになるにはかなりのエネルギーが必要です。
反対に青い部分の第1族元素(アルカリ金属)は、価電子数が1です。この邪魔なやつを放り出せば、18族と同じ安定な状態になるので、電子を出したくて仕方がない状態になっています。なので、こちらは1価の陽イオンになるのがむしろ自然で、そのために必要なエネルギーも少ないということになります。
基本的には、イオン化エネルギーの大きさは下記のルールに沿っています。
同一周期:周期表の右側ほど大きい
理由:周期表の左側から右側へ行くにつれ、陽子数が増える。陽子数が増えれば最外殻電子を原子核へ引き寄せるクーロン力が強くなり、電子を放出しにくくなる
同族:周期表の下に行くほど小さい
理由:周期表の下に行くほど、電子殻が大きくなる。電子殻が大きくなるほど、最外殻電子を原子核に引き付けるクーロン力は弱くなり、電子を放出しやすくなる
さて、ルールがあるとそれに従わないやつがいるのが世の常で、このイオン化エネルギーでも、B、O、Al、Sについては上の基本ルールには沿っていません。
(こちらよりお借りしました)
上の通り、この4つのイオン化エネルギーは少し下がっているんですよね。
昨日はこれについてビデオを止めて、なぜかと考えて仮説をたて、調べてみました。
課題:B、O、Al、Sのイオン化エネルギーはなぜ低いのか?
仮説:
- B、Alは最外殻のp軌道に不対電子が一つ存在している。p軌道の方がs軌道より遠いので陽子のクーロン力の影響を受けにくい
- O、Sはp軌道に一つの電子対、二つの不対電子が存在している。電子対になっている電子はそれぞれが反発しあうため、不安定になる
調査後の結論:
1.B、Alについて
B、Alは直前のBe,Mgの最外殻電子がs軌道に存在していたのに対し、p軌道に入るようになった
s軌道よりp軌道のほうがエネルギー準位が高く、不安定な状態。不安定であればイオン化しやすいため、イオン化エネルギーは低くなる
2.O、Sについて
電子対になっている2つの電子がクーロン力で反発しあう。そのため不安定になる。また、電子対になっている2つの電子の一方が放出されれば、p軌道の3つの部屋すべてがひとつの上向きスピンのみで埋まる半閉殻という安定した状態になるので、その状態に向かいやすい。
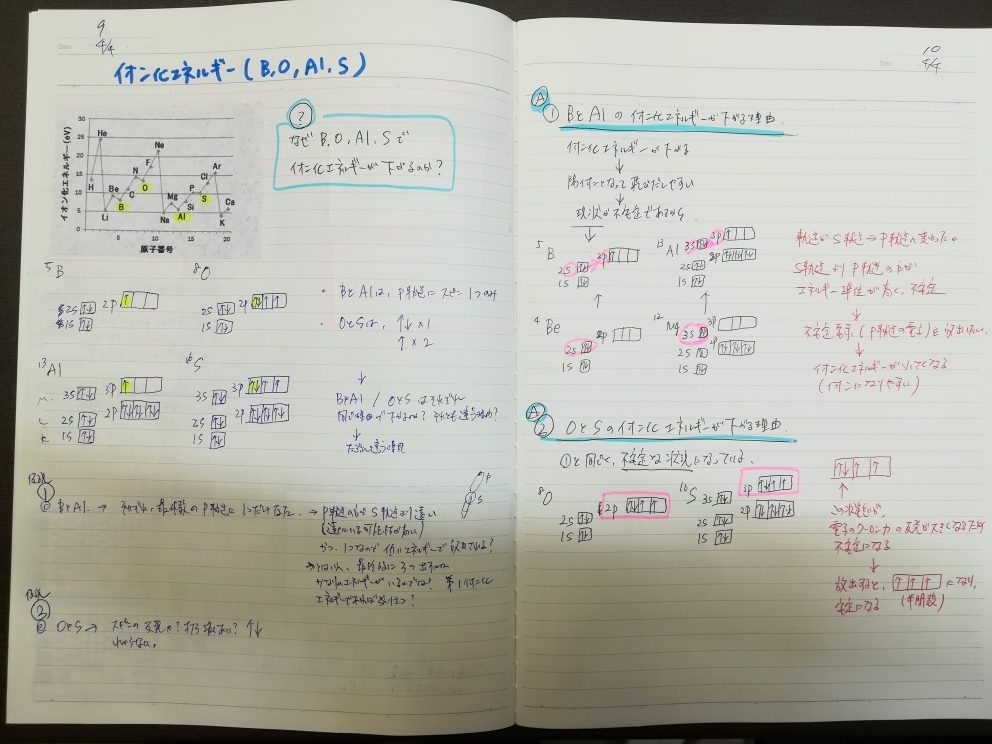
ノートに電子配置を書きつつ、考えました。
ルールを守らないやつらも、物質は安定化に向かうというもっと大きな法則からは逃れられないのですね。と言いつつ、この前少し調べた銅などは、さらにアウトローなやつだったみたいですね。今のところは近づかないようにしておきます。レベルを上げてから戻ってきます。
4/4(水)の学習記録
学習時間:6h40m
項目: 昨日の復習
目標: 20m 実績: 20m
項目: 岡野の化学(87)
目標: 1h 実績: 55m
項目: 岡野の化学(88)
目標: 2h30m 実績: 5h25m
メモ: B、O,Al,Sのイオン化エネルギーについて、仮説を立てて調べてみる。
項目: 岡野の化学(89)
目標: 2h 実績: 未完了
項目: 岡野の化学(90)
目標: 2h30m 実績: 未完了
4/5(木)の行動計画
項目: 昨日の復習+資料をノートにまとめる
目標: 45m
項目: 岡野の化学(89)
目標: 2h
メモ: 昨日の予定からの積み残し
項目: 岡野の化学(90)
目標: 2h30m
メモ: 昨日の予定からの積み残し
項目: 岡野の化学(91)
目標: 2h30m